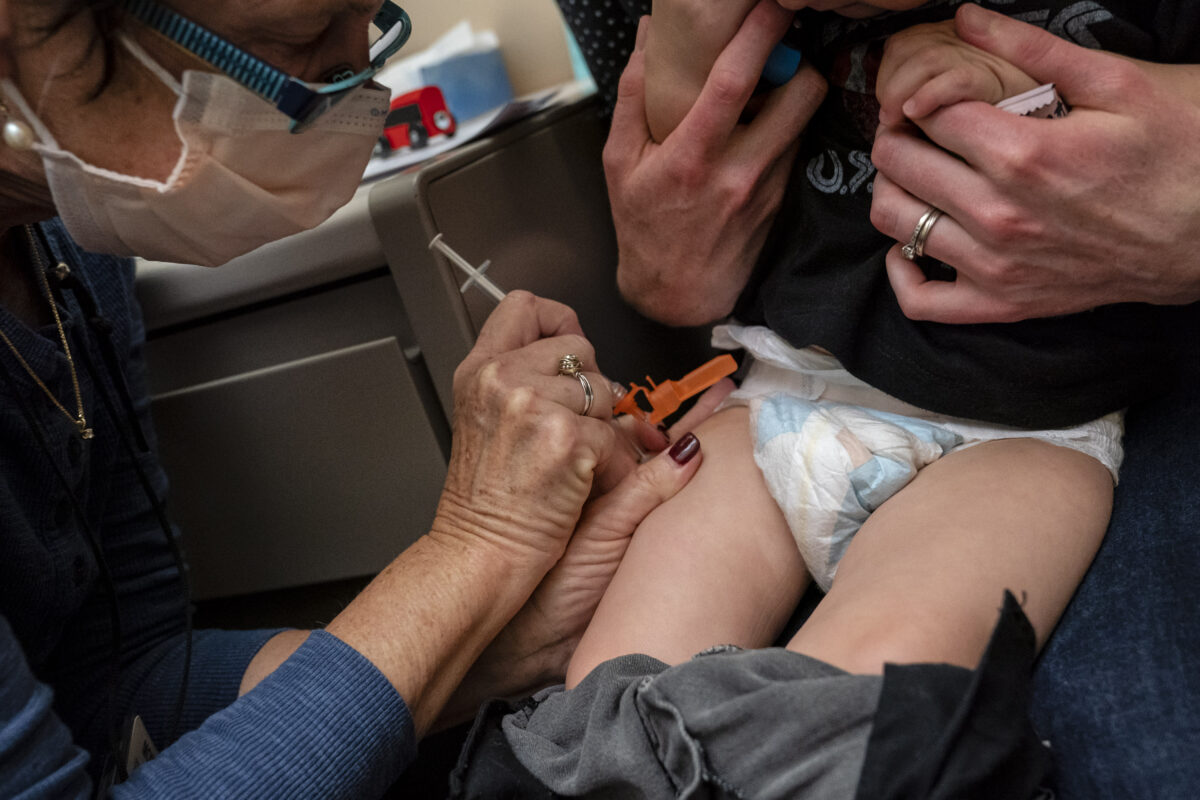
Americký Úřad pro kontrolu potravin a léčiv (FDA) 8. prosince oznámil schválení dvou anticovidových vakcín v nouzovém režimu pro děti ve věku od 6 měsíců.
FDA sdělil, že aktuální vakcíny od společností Pfizer a Moderna je nyní možné podávat i mladším dětem, neboť dříve byly dostupné pouze pro děti starší 5 let.
Starší druhy vakcíny jsou založeny na spike proteinu wuchanského kmene. Nové vakcíny obsahují složky jak wuchanského kmene, tak subvariant BA.4/BA.5. Tyto vakcíny se nazývají bivalentní.
Při zdůvodňování svého rozhodnutí se úředníci nepodloženě domnívají, že vakcíny chrání před závažnými onemocněními a hospitalizací.
„Vzhledem k tomu, že se tento virus změnil a imunita z předchozího očkování proti covidu-19 slábne, čím více lidí bude mít aktuální očkování proti covidu-19, tím větší přínos bude mít pro jednotlivce, rodiny a veřejné zdraví, protože pomůže předcházet závažným onemocněním, hospitalizacím a úmrtím,“ uvedl v prohlášení dr. Robert Califf, komisař FDA.

Pro aktuální vakcíny nejsou k dispozici žádné údaje o klinické účinnosti. Regulační orgány se při jejich původním schvalování na podzim opíraly o údaje pocházející od myší a z jiné sady upravených vakcín a uvedly, že údaje o bezpečnosti pocházejí ze starých vakcín.
„Jak se může jakýkoli lékař dívat na rodiče a trvat na tom, že je to pro jejich děti ,bezpečné‘, když to nikdy nebylo testováno na lidech?“ uvedla na Twitteru Kim Witczaková, obhájkyně bezpečnosti léků.
Jediné odhady účinnosti, které z reálných podmínek vypracovalo americké Centrum pro kontrolu a prevenci nemocí (CDC), zjistily, že ochrana proti symptomatickému onemocnění byla velmi slabá, zejména u mladších lidí.
Dr. Harvey Risch, emeritní profesor epidemiologie na Yale School of Public Health, řekl tento týden deníku The Epoch Times, že původní vakcíny, natož ty z velké části netestované nové, neměly být pro malé děti vůbec povoleny.
Poznamenal, že varianty BA.4 a BA.5 ze Spojených států buď vymizely, nebo jsou na ústupu, zatímco novější varianty se stávají dominantními.
Dopisy
V dopisech výrobcům vakcín, kterými se upravuje povolení k mimořádnému použití bivalentních vakcín, byly regulační orgány ve formulacích opatrnější.
Na základě současných důkazů se „lze důvodně domnívat“, že vakcíny „mohou být účinné“, napsaly. Rovněž uvedly, že na základě všech dostupných vědeckých důkazů je „rozumné dospět k závěru, že známé a potenciální přínosy“ vakcín „převažují nad známými a potenciálními riziky“.
Povolení se týkají prevence proti covidu-19. Z vedlejších účinků hrozí například zánět srdce a Bellova obrna.
Úřad FDA vydání nových povolení nekonzultoval se svým poradním panelem pro vakcíny.
Společnosti Moderna i Pfizer nový vývoj slavily.
„Díky rozhodnutí úřadu FDA budou mít nyní děti a dospívající všech věkových skupin v USA nárok na naši aktualizovanou bivalentní posilovací vakcínu proti covidu-19. Rodiny tak budou mít k dispozici důležitý ochranný nástroj i v zimních měsících,“ uvedl v prohlášení Stéphane Bancel, generální ředitel společnosti Moderna. „Oceňujeme včasné přezkoumání ze strany FDA.“
„Toto povolení nabízí rodičům možnost pomoci lépe chránit své malé děti proti covidu-19, včetně onemocnění způsobených podtypem omicron,“ dodal Albert Bourla, generální ředitel společnosti Pfizer.
Další kroky
CDC musí rozhodnout, zda by aktuální vakcíny měly dostat všechny děti v nejmladší věkové skupině. CDC se v průběhu pandemie nikdy neodchýlilo od rozhodnutí FDA.
Pediatři a další osoby si již mohli bivalenty předobjednat.
„Pro tyto věkové skupiny bude k dispozici dostatečná, ale omezená zásoba dětských bivalentních anticovidových vakcín, která by měla být směřována k poskytovatelům s očekávanou poptávkou mezi způsobilými pacienty,“ uvedlo CDC v příručce pro operační plánování.
Předpokládaná poptávka není předvídatelná, protože mnoho rodičů se rozhodlo, že své kojence a batolata očkovat nenechají.
K 30. listopadu obdrželo v USA jednu nebo více dávek vakcíny pouze 1,8 milionu dětí mladších 5 let. Podle údajů ze sčítání lidu v USA žije ve Spojených státech téměř 19 milionů dětí mladších 5 let.
Úřad FDA uvedl, že zváží povolení další posilovací dávky nové vakcíny pro děti, které obdrží Pfizer vakcínu.
„Údaje podporující poskytnutí aktualizované bivalentní posilovací dávky pro tyto děti se očekávají v lednu,“ uvedl FDA. „Agentura je odhodlána tyto údaje co nejrychleji vyhodnotit.“
Z původního článku newyorské redakce přeložil: MiC. Článek byl redakčně zkrácen.